Instrukcje dla nauczyciela do symulacji PhET - Skala pH
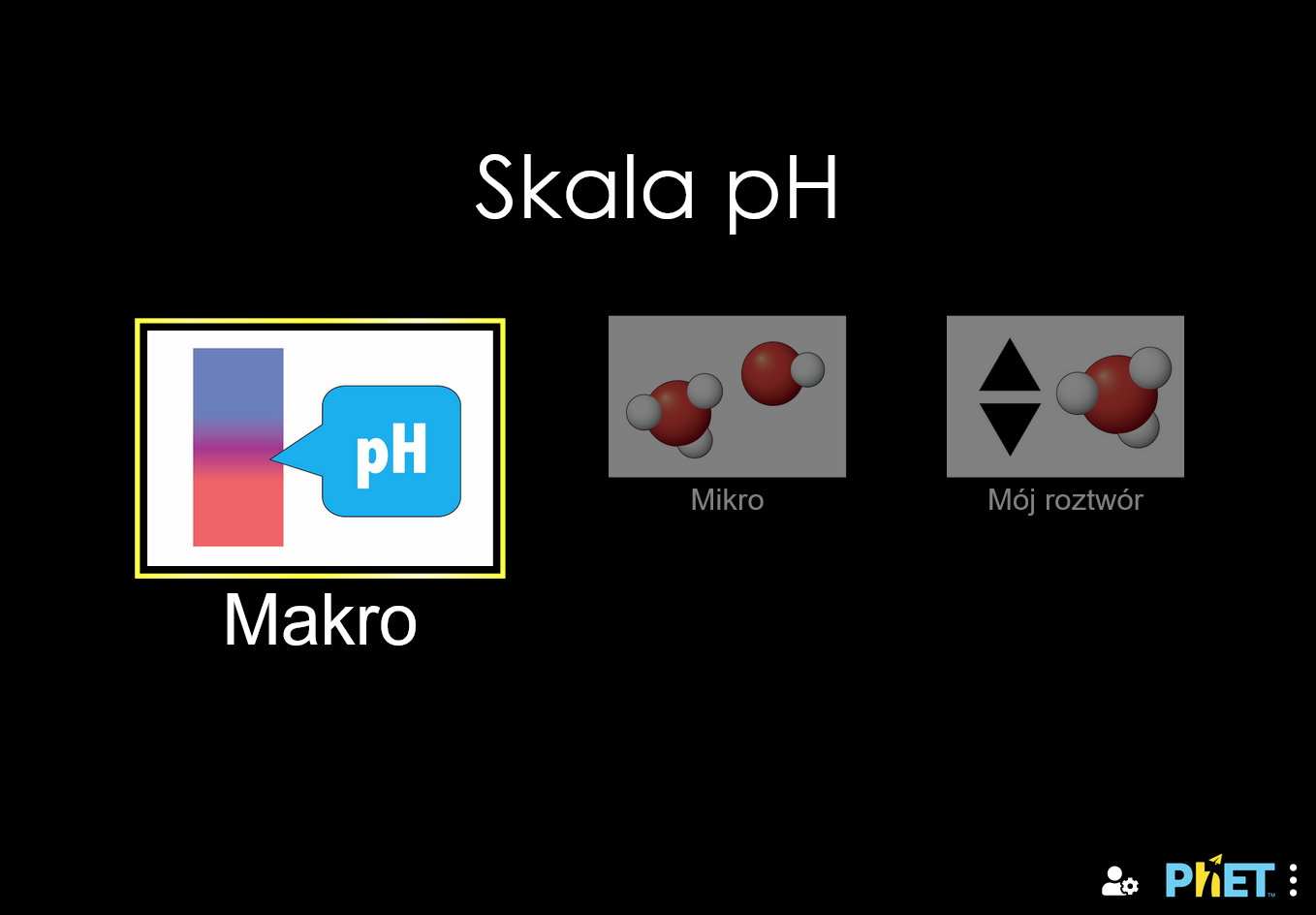
Sprawdź pH substancji, takich jak kawa, ślina, czy mydło w celu ustalenia, czy odczyn jest kwaśny, zasadowy, lub neutralny. Wizualizuj względną liczbę jonów wodorotlenowych i jonów hydroniowych w roztworze. Przełączaj między skalą logarytmiczną i liniową. Zbadaj, czy zmiana objętości lub rozcieńczenie wodą wpływa na pH. Można też przygotować własny płyn!
PhET Interactive Simulations, University of Colorado Boulder, https://phet.colorado.edu Na licencji CC BY 4.0
W opracowaniu niniejszego poradnika wykorzystano materiały PhET: Strona źródłowa symulacji, Teacher Tips (Rouinfar, sierpień 2023)
W szablonie strony wykorzystano kod html/css: phydemo.app.
Szkoła podstawowa, szkoła średnia
Testowanie pH płynów codziennego użytku w celu określenia, czy każdy z nich jest kwaśny, zasadowy czy neutralny.
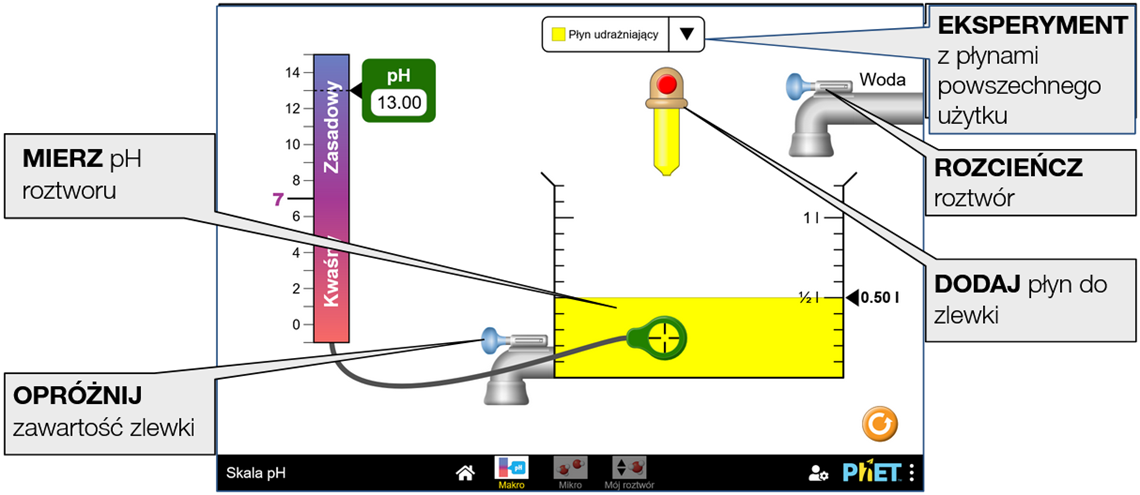
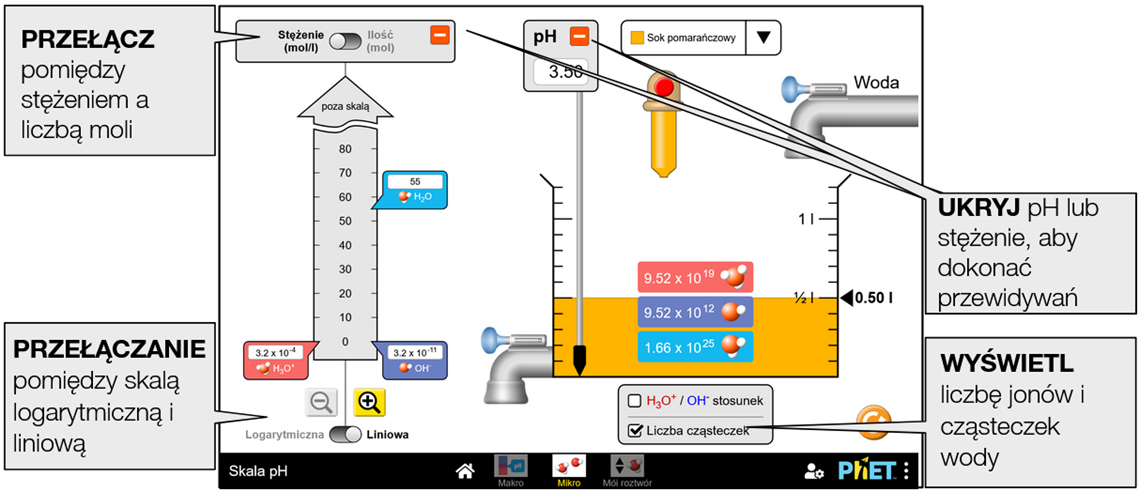
Eksperymentowanie z płynami codziennego użytku i powiązanie pH ze stężeniem jonów hydroniowych i wodorotlenkowych.
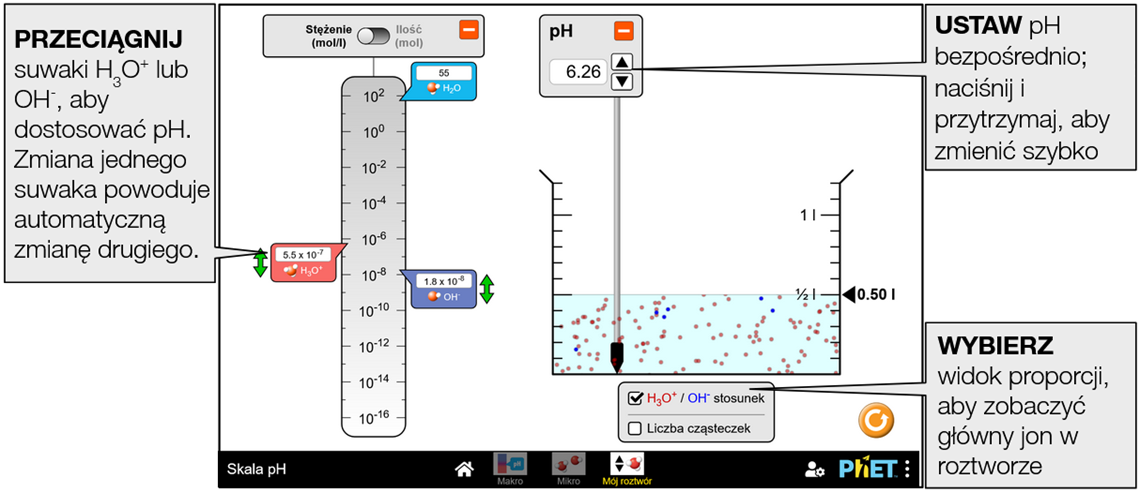
Stwórz własny płyn, bezpośrednio manipulując pH lub stężeniem jonów. Wizualizacja względnej liczby jonów wodorotlenkowych i hydroniowych w roztworze.
Poniższe parametry query umożliwiają dostosowanie symulacji i można je dodać, dołączając znak '?' do adresu URL symulacji i oddzielając każdy parametr query znakiem '&'. Ogólny wzorzec adresu URL to: …html?queryParameter1&queryParameter2&queryParameter3
Na przykład, jeśli w symulacji Skala pH chcesz uwzględnić tylko pierwszy i drugi ekran (screens=1,2), z domyślnie otwartym drugim ekranem (initialScreen=2), użyj: https://www.edukator.pl/tik_edukator/ph-scale_all.html?screens=1,2&initialScreen=2
Aby uruchomić to w języku polskim (locale=pl), adres URL będzie wyglądał następująco: https://www.edukator.pl/tik_edukator/ph-scale_all.html?locale=pl&screens=1,2&initialScreen=2

Wskazuje, że dostęp do tego dostosowania można uzyskać też z menu Preferencje lub Opcje... w symulacji.
| Parametr query i opis | Przykładowe linki |
| autofill - gdy true, zakraplacz automatycznie napełni zlewkę do do 0,50 l podczas zmiany substancji rozcieńczanych. Domyślnie jest false. | autofill=true |
| screens - określa, które ekrany są włączone do symulacji i jaka jest ich kolejność. Każdy ekran powinien być oddzielony przecinkiem. Więcej informacji można znaleźć w Centrum pomocy. | screens=2,1 screens=3 |
| initialScreen - otwiera kartę SIM bezpośrednio na określonym ekranie, z pominięciem ekranu głównego. | initialScreen=1 initialScreen=2 |
 locale - określa język symulacji przy użyciu kodów ISO 639-1. Dostępne wersje językowe można znaleźć na stronie symulacji w zakładce Tłumaczenia. Uwaga: działa to tylko wtedy, gdy adres URL symulacji kończy się na “_all.html”. locale - określa język symulacji przy użyciu kodów ISO 639-1. Dostępne wersje językowe można znaleźć na stronie symulacji w zakładce Tłumaczenia. Uwaga: działa to tylko wtedy, gdy adres URL symulacji kończy się na “_all.html”. | locale=pl (polski) locale=fr (francuski) |
| allowLinks - jeśli false, wyłącza linki, które prowadzą uczniów do zewnętrznego adresu URL. Domyślnie jest true. | allowLinks=false |
| supportsPanAndZoom - gdy false, uniemożliwia przesuwanie i powiększanie symulacji za pomocą pinch-to-zoom lub elementów sterujących zoomem przeglądarki. Domyślnie jest true. | supportsPanAndZoom=false |
Po kliknięciu ikony menu Preferencje  otworzy się okno, w którym w sekcji Lokalizacja możemy zaznaczyć język angielski lub polski (domyślny jest polski):
otworzy się okno, w którym w sekcji Lokalizacja możemy zaznaczyć język angielski lub polski (domyślny jest polski):

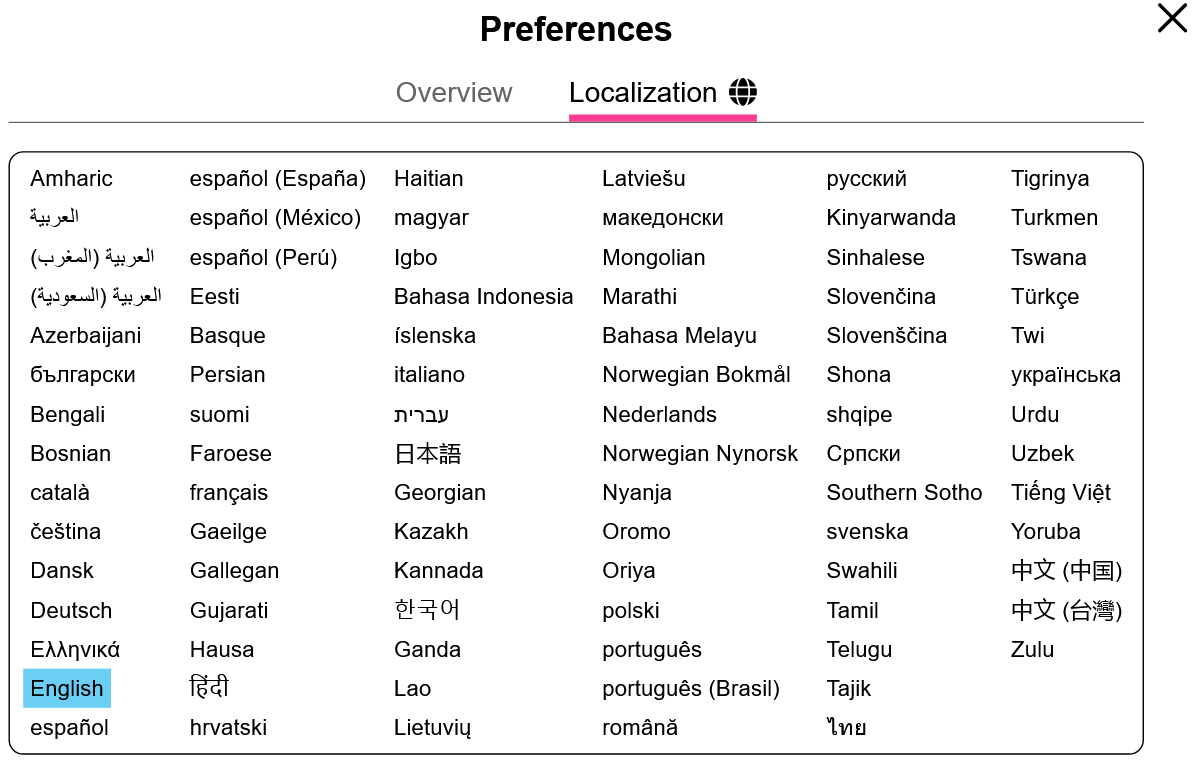
Gdy adres URL symulacji kończy się na "_all.html", w sekcji Lokalizacja możemy dokonać wyboru języka spośród wszystkich dostępnych (domyślny jest angielski):

Po kliknięciu logo PhET (na dole po prawej) pojawia się okno zawierające informacje dotyczące symulacji. Możemy tu zmienić sposób jej wyświetlania.
Klikając Pełny ekran przechodzimy do trybu pełnoekranowego (powrót - klawisz escape).
Dostępne są również wersje symulacji niewymagające połączenia z internetem.
Aplikacja PhET Desktop zawiera wszystkie symulacje HTML5 i Java, w tym ich tłumaczenia, do użytku offline w systemach Windows i macOS (dostępne po zalogowaniu tu). Symulacje HTML5 nie wymagają dodatkowego oprogramowania, natomiast do uruchamiania dowolnych symulacji Java w aplikacji komputerowej jest wymagany Java SE Development Kit 8.
Za symboliczną opłatą możemy pobrać w postaci jednej aplikacji wszystkie materiały PhET, które zostały opublikowane w html5. Telefony, tablety i Chromebooki (z systemem Android): Google Play. iPhone'y i iPady (aplikacja na iOS): App Store
Darmową wersję desktopową tej aplikacji pobierzemy bezpośrednio klikając tu - wersja _pl zawiera polską (domyślną) i angielską wersję językową i tu - wersja _all zawiera angielską (domyślną) i wszystkie inne dostępne wersje językowe lub ze strony PhET (klikając przycisk ze strzałką przy wybranej wersji językowej):

Wskazówki dotyczące wszystkich symulacji zawarte są w informacjach ogólnych.
Więcej porad dotyczących korzystania z symulacji z uczniami można znaleźć na stronach PhET w sekcji Wskazówki dotyczące korzystania z PhET.
Zobacz wszystkie opublikowane na stronach PhET aktywności dla Skala pH tutaj (dostęp do materiałów wymaga zalogowania).